Biotech商业化闭环的可持续优势
2022-06-08 中国医疗健康网
中国生物医药爆炸式发展的这些年里,过千家的Biotech公司在国家层面政策激励、全球新技术突破、批量高端人才归国和海内外专业资本大手笔投入的背景下,如雨后春笋般野蛮生长。每个参与者都梦想连过三关,一是在关键股票市场公开发行募资,二是不断有创新药物获批上市,三是销售高增长带来盈利,最终能成功商业化蜕变为一家Pharma。
基于港交所18A上市规则,从18年4月到22年5月,已有五十家左右未盈利生物科技公司在港股市场IPO,募得资金达到1100亿港元以上,可谓过了第一关。而其中少数上市公司在21年已有具备行业先进性的候选药物获批上市,可谓第二关进行时,像百济、信达、基石、再鼎、君实、康方、诺诚健华这几家,都是优中选优的种子选手。第三关则仍是所有人努力的方向。
五月底,基石药业披露了2021年报,作为首次有产品上市的商业化元年,其新药获批的成绩非常亮眼,可谓厚积薄发。自2021年3月起至今,其具备全球先进性的四款药物分子的八项新药上市申请获得批准,像再鼎商业化时间更早,目前获批疗法也是四款,而君实、康方、诺诚健华则更少一些。基石药业在大约三个季度里,以两款小分子药物的销售为主,收入达到2.437亿元,自我造血最关键的第一步已经迈出。更值得期待的是,2021年12月获批首个大适应症的重磅药物择捷美®就在5月底获批了第二个大适应症,销售势必将在2022年放量,今年收入将数倍增长。
当前美股港股A股,生物科技类企业整体表现并不符合寿命延长和技术突破带来的医药需求快速增长状态,这一点迟早会得到修正。要在未来行业受宠时大鹏展翅,加速商业化的Biotech公司除了爆款品种外,还必须有可持续优势,即超越了单一产品的表现而赋予了企业长期向上动能的品质。笔者以基石药业为例,尝试对可持续优势的源泉进行分析,得到了四个启发点,即同类首创与最优思维,下一代药物管线2.0计划,高研发质量下的基石速度,和丰满的商业运营体系。
一、同类首创与最优思维—产品潜力
内卷是新药创制浪潮中难以回避的话题。而突破内卷第一要务是识别细分的未满足的临床需求,差异化临床应用,道理不言自明。那什么是差异化,必然要做同类首创和同类最优。基石药业所有获批药物全部是同类首创或者同类最优,在研品种也同样具有这种潜质,这是一以贯之的思维路径。下图囊括了四款上市药物。

普吉华®(普拉替尼胶囊)是同类首创RET抑制剂,2021年在中国大陆获批用于RET突变相关的非小细胞肺癌(NSCLC)领域。由于其目前是中国唯一获批的RET突变靶向药物,于国内市场处于完全领先地位。
泰吉华®(阿伐替尼片)是同类首创KIT/PDGFRA抑制剂,获批用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的胃肠道间质瘤患者。中国唯一,完全领先。
拓舒沃®(艾伏尼布片)是同类首创IDH1抑制剂,获批用于IDH1突变的复发或难治性急性髓系白血病(AML)。中国唯一,完全领先。
择捷美®(舒格利单抗注射液)是同类最优的PD-(L)1单抗,2021年12月获批用于一线治疗鳞状和非鳞状IV期NSCLC患者,2022年5月获批用于治疗同步或序贯放化疗后未发生疾病进展的III期NSCLC患者。实际上,择捷美®已成为全球首个同时覆盖III 期和 IV 期NSCLC适应症的PD-(L)1抗体,并独占更符合中国临床实践的经序贯放化疗的III期NSCLC患者治疗市场。
获得同类首创和同类最优的评价不是目的,通过这种评价获得市场先机才是。这四个品种都已取得了首战之功,但基石药业对他们的期望远远不止于此。
普吉华®的第二个适应症已于今年在中国大陆获批,用于RET突变型的甲状腺髓样癌和RET融合阳性甲状腺癌领域。广泛的潜在晚期RET阳性实体瘤适应症,即结直肠癌、胃癌、乳腺癌、肝癌、宫颈癌、卵巢癌、食管癌和胰腺癌等,正处于篮式试验过程中。此外,中国香港和中国台湾也已受理了普拉替尼的NDA申请。到2025年,预计中国新诊断的RET基因突变阳性患者大约7万人。
泰吉华®的新方向是晚期系统性肥大细胞增多症(SM),美国FDA已经批准了阿伐替尼片这一适应症。预计2025年新诊断的PDGFRA外显子18和/或KIT突变的中国患者人数约4.5万人。
拓舒沃®近日获美国食品药品监督管理局(FDA)批准用于一项新适应症,即拓舒沃®(艾伏尼布片)联合阿扎胞苷用于治疗75岁及以上初治的IDH1突变急性髓系白血病(AML)患者或因其它合并症而无法接受强化诱导化疗的初治的IDH1突变AML成人患者。他的拓展适应症方向还包括IDH1突变的胆管癌患者。由于艾伏尼布片是首个且唯一获得美国FDA批准用于IDH1突变胆管癌患者的靶向药物,且临床有迫切需求,今年3月该药物已获准在中国博鳌乐城先行区用于胆管癌患者。预计2025年新诊断的IDH1突变中国患者约4.5万人。
择捷美®在NSCLC外的新战场首先是复发或难治性结外自然杀伤细胞/T细胞淋巴瘤(R/R ENKTL),近期就可能提交上市申请,有望成为全球首个该领域的免疫治疗药物,并且,在胃癌和食管鳞癌领域注册性临床的受试者入组也已经完成。中国NSCLC患者每年确诊超过67万,七成属于III期和IV期,胃癌和食管鳞癌也是中国高发肿瘤类型,年新发患者数量也均在30万级别。预计2025年,择捷美®覆盖的新诊断患者人数达到百万,其中有20万左右是独占市场的经序贯放化疗的III期NSCLC患者。
同类首创和同类最优是市场竞争力的基础,再考虑到市场本身的巨大规模,产品销售自然有大机遇。
二、下一代药物管线2.0计划—持续创新
全球生物医药科技发展是越来越快,技术突破层出不穷。如果一家公司不做紧跟技术突破的新产品,资本市场会很失望;但如果为了创新而创新,多半根基不牢造成资源浪费,而当前几家头部18A公司现金基本覆盖两年左右研发支出。无论技术本身多么性感,候选药物也必须从真实的未满足的临床需求出发,必须从技术成熟度出发,基石药业的管线2.0计划就是如此。
该计划现在已有两个已经处于临床阶段的极具前景的品种,即CS5001(ROR1 ADC)和CS2006(PD-L1 x 4-1BB x HSA三抗)。
CS5001是一款靶向ROR1靶点的抗体偶联药物ADC。ADC的结构理念促使该类药物只在病灶地区发挥作用,而在对其他正常组织影响较小。ROR1靶点在包括白血病、非霍奇金淋巴瘤、乳腺癌、肺癌、卵巢癌等多种肿瘤细胞表面高表达,而在正常组织极少存在,非常适合开发ADC药物满足临床需求缺口。
目前全球范围内,ROR1 ADC第一梯队有三家药企,其中一家就是基石药业。前三中另外两款都已经被跨国药企以高价收入囊中,像默克以 27.5 亿美元收购 VelosBio ,其主要产品为VLS-101( I/II 期);勃林格殷格翰以 14 亿美元收购 NBE ,其主要产品为 NBE-002 ( I 期)。以此推测,具备差异化的基石药业CS5001当前的交易价值呼之欲出。
CS5001通过结构的差异化设计,实现了精准的药物抗体比率以便于实现均质生产及大规模生产,并且相比传统ADC有望具备更宽的治疗窗口,在实体癌和血液瘤中均取得出色的临床前数据。目前,它正在包括美国和中国的全球范围内进行临床研究,一旦开发成功,每年覆盖全球的新发病患大约300万例。
CS2006的潜力相比CS5001也不遑多让。它同样设计独特,实现了精巧且平衡的PD-L1与4-1BB的亲和性,在临床前研究中,其对于冷热肿瘤都有效,通过结合HSA延长半衰期并带来给药便利,有望避免使用传统4-1BB激动剂抗体时所观察到的肝毒性,可以克服内外部因素介导的PD-(L)1耐药,而耐药是肿瘤疗法主角PD-(L)1抗体目前面临最大的问题之一。目前,CS2006在美国和中国都进行着临床研究,一旦开发成功,有望成为潜在同类最佳4-1BB激动剂以及下一代PD-(L)1抑制剂。它作为新型肿瘤免疫骨架产品,其潜在市场规模动辄数百亿美元。
事实上,基石药业正在开发多款下一代药物,已经具备实现每年提交1 至2 个IND的长期目标的能力。这种优势的根源在于一种即插即用的模式。

如上图,这种模式允许将各种模块与抗体骨架结合,过程就像组装一台电脑,模块提供不同的特异性及功能性。这种模式非常高效,目前基石药业已启动的此类处于发现阶段的项目达到10个,涵盖多抗,ADC,抗体细胞因子融合分子和PROTAC等。
基石药业的持续创新力,一是靠深厚的临床经验超前识别新技术潜力以赢得半个身位的领先,二是靠以技术平台为基础的创新模式将候选品种打磨到既新又稳的程度再推进临床阶段。如果技术团队不够资深,这两点都是做不到的。
三、高研发质量下的基石速度—高执行力

基石速度是一直被业界称赞的。
基石药业在十二个月内获得四款产品的NDA批准,公司成立后的五年多时间内达到商业化发展阶段,且包含小分子和抗体药,须知这是很多生物技术公司十年甚至更久才能达到的成就。并且在2022年,预计共有 3 项NDA获批和 6 项NDA提交。
临床推进上,择捷美®堪称业界速度典范,2017年4季度,当基石药业启动其临床试验的时候,它是中国第12个进入人体试验阶段的PD-(L)1抗体;至2020年11月舒格利单抗第一个适应症上市申请获得受理,它是中国第4个可用于联合化疗一线治疗IV期NSCLC患者的PD-(L)1抗体,且表现出同类最佳潜力;至2022年5月第二个适应症获批,它成为全世界第一个横跨III期和IV期NSCLC的PD-(L)1抗体。从中国第十二直冲全球第一。
基石质量同样受到业界瞩目。2021年,基石药业受邀在国际学术会议上进行七次口头报告展示相关临床研究数据,口头报告是一种大会殊荣,而一年七次在中国Biotech中是很罕见的,证实基石的研究质量获得全球同行的认可。
四、丰满的商业运营体系—商业路线清晰
所有的商业化过程中,最重要的部分就是建立丰满的商业运营体系,这是能带来长期合作伙伴和市场能力的核心保障。从内到外,基石药业基于行业特点的商业路线布局非常清晰。
第一,是自身营销体系建设。
内部上层由全能型、跨国公司背景、数十年执行经验的商业领导团队构成,他们过往的业绩包括成功上市30 多款肿瘤及血液相关药物。销售端已有全职员工300人,覆盖 130个城市的600家以上的医院,直达70-80%的精准治疗药物潜在市场。
得益于此体系,普吉华®和泰吉华®的上市速度超越常规。普吉华®上市仅一个月,在大约100家医院开具处方,覆盖70个城市的80家高值新特药直送平台--DTP药房。泰吉华®抵达中国后4天触达分销商合作伙伴,上市仅一个月,在大约50家医院开具处方,并覆盖 50家DTP药房。2021年收入中,超过1.6亿元来自于普吉华®和泰吉华®不到八个月的销售,对于此种规模的销售团队的第一年,这个成绩很不错。2022年,精准治疗上市药物又新增拓舒沃®,目前覆盖面已达130家医院的500名血液病专家。
第二,是借助战略合作伙伴力量,进入更有竞争挑战的市场。
PD-(L)1抗体的国内市场拓展需要较大前期投入和人力资本,基石药业择捷美®国内市场与宇宙药厂辉瑞合作,辉瑞肿瘤销售代表达到1000人,覆盖核心和县域市场的4600家以上的医院,这已是国内肿瘤药物市场的90%;基于良好合作,择捷美®在国内NDA获批后18天内实现首次商业销售,目前已有500多家医院/DTP药房可提供药物。
海外市场拓展则需要巨额申报资金,且最好是美国公司进行。舒格利单抗海外市场与纳斯达克上市公司EQRx合作,EQRx正与FDA就在美国申报IV期NSCLC适应症事宜持续开展积极沟通,同时预计2022年下半年在美国之外地区递交首个关于IV期NSCLC的NDA;此外在ENKTL适应症上,舒格利单抗已经获得FDA“突破性疗法认定”,且研究包含美国患者,目前计划在2023年递交BLA。下图是EQRx针对舒格利单抗海外市场的初步开发战略。

第三,是通过行业合作及城市商业保险大发展的东风,努力提升药品可支付性和可及性。
普吉华®和泰吉华®已列入60个以上的商业保险计划,包括诸多城市商保,大大提升患者可支付性。城市商业保险收费低,赔付率高,保障药品数量多且带有专特新贵属性,人人有当地医保即可参保且免等待期免健康状况。诸多便利情况下,在东部发达地区如上海江苏浙江参保人数已经非常庞大。
第四,是继续与行业内其他药企达成广泛合作,各取所需。
基石药业2021年之前已分别与辉瑞和EQRx达成合作,合同金额巨大,广为业内所知。2021年,又与国内龙头药企恒瑞就抗CTLA-4单抗CS1002达成大中华地区的战略合作及独占许可协议,基石药业可获得的首付款和里程碑付款金额达到2亿美元。
在与全球其他Biotech的管线合作中,基石的目标是获得具有广泛的患者覆盖或强溢价潜力的创新药物,以便进一步快速夯实管线2.0计划;而与跨国药企的多维度合作中,基石注重建立全球网络,将触角延伸至中国以外的市场。下图囊括了基石药业深度合作的伙伴。
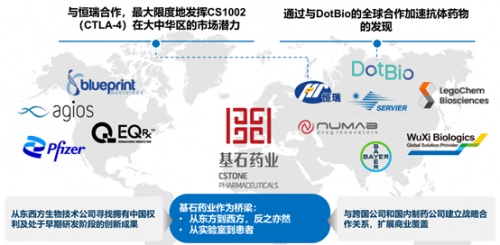
上面所有这些商业布局的终极目标,就是在医患和合作伙伴心目中树立基石药业的品牌。
在复杂的大环境下,尤其是21年下半年开始,全球资本为具有较长发展期的高增长行业烧钱的欲望在减弱,而更倾向于投入到已有盈利的确定性商业模式中。高投入高风险高回报长周期的生物医药全行业面临挑战,从美股纳斯达克到港股18A,医药和生物技术公司在遭遇普跌。这显然不是某家公司估值调整的问题,而是华尔街避险情绪占了上风。
但这只是硬币的一面,还需要看到另一面,那就是中国数亿快速老龄化人口的持续用药需求,关键药物的进口替代与国产创新,城市商保快速普及带来支付能力的大幅提升,以及港股18A相比巅峰的三折估值,这些是贝塔收益的长期来源。困难时刻,一方面保持对市场敬畏,谨慎再谨慎,另一方面要坚持寻找如基石药业这样产品有潜力、创新可持续、高执行力和商业路线清晰的投资标的,这些是阿尔法收益的长期来源。
来源:公子豹投资圈