精益赋能,水木菁创助推医疗器械临床试验发展
2022-08-10 编辑:刘军
我国医疗器械行业前景广阔,其产业价值链中高壁垒、高技术创新的研发制造和服务企业更是未来可期。医疗器械应用于现实的需要,使人们对医疗器械设备的要求越来越高,对临床试验项目的推进也越发关注。国家把医疗器械创新放到了前所未有的高度,医疗器械行业将持续地在政策红利中健康发展。医疗器械行业发展新周期已经启动,随着监管愈加严格,加大飞行检查力度,企业合规意识将不断增强。
近日,北京中关村水木医疗科技有限公司(以下简称“中关村水木医疗”)完成了亿元级A+轮融资,投资方为沂景资本与松和资本。据了解,这是中关村水木医疗继去年8月份A轮亿元融资后的追加融资。中关村水木医疗集团目前已发展成业务覆盖全国,集工程化研发、检验检测、临床试验、注册(含IVD标准品和质控品研发生产)于一体的全产业链一站式服务平台。A+轮融资的圆满成功,意味着中关村水木医疗集团迎来了进一步发展,其将扩大服务领域范围,布局医疗器械的CDMO和动物实验等服务。

集团旗下的北京水木菁创医药科技有限公司(以下简称“水木菁创”)致力于为医疗器械企业提供一站式CRO服务,在医疗器械服务方面具有强大优势。这些年,水木菁创团队凭借着行业经验和强大的平台整合能力,始终立足于洞悉最新法规视角、把控核心技术项目管理,为客户提供优质的一站式服务,卓越的战略决策和执行力构筑起独具优势的核心壁垒,推动公司稳步发展。
水木菁创团队中,核心部门员工100%为医学背景学历,中层以上员工,CRO从业经验平均超十年。目前公司建立建全的8大中心,包括质量管理中心、法规事务中心、临床运营中心、医学中心、IVD事业部、商务中心、人事行政中心、财务中心……水木菁创自创立以来,始终秉持“善为、敢为、勤为、有为”的宗旨,严格把关不同部门密切配合,通力合作,专注于为医疗器械企业提供优质、高效、精准、便捷的一站式产品上市解决方案,构建医疗器械全生命周期服务平台。作为临床评价,尤其是在临床试验项目中,医学中心坚持科学、严谨、可行的学术态度,坚守原则。医学中心三个部门(医学部、数据管理部、生物统计部)通力合作,严格遵守公司SOP和合规化管理,在项目执行过程中体现的严谨性,为项目顺利开展提供可靠保障。医学中心的技术输出贯穿整个临床试验项目实施的全过程,也为接下来法规事务中心推动医疗器械产品成功注册打下坚实基础。

医学中心:循证医学,科学且严谨
自成立以来,水木菁创致力于为中国医疗器械研、检、产、商提供专业支持,推动产品快速上市。其中,医学中心为临床试验项目安全、合理、有序地开展,提供临床试验设计、临床评价报告撰写、临床试验数据分析、样本量计算、统计分析报告撰写、CRF/eCRF设计、医学编码、数据管理报告撰写等支持工作。
医学中心层层把关,内外审核,推进各流程。作为先锋队的医学部,首当其冲要快速熟悉产品的适用范围和各项性能,从而结合具体产品的适用范围和性能特点依据循证医学证据、相关法规、指导原则进行试验方案设计。临床试验项目的顺利启动,每一步都需严谨对待。如医学部在临床试验方案撰写过程中,从医学负责人的选定到方案的落实,每个审核过程都需仔细审查,落实到位。在方案与申办方达成共识之后,还要与临床试验主要研究者频繁磋商;不仅要考虑方案整体的科学性、合规性,还要考虑注册临床试验的目的性,既要科学严谨,又要符合医疗器械法规审评要求,确保项目可执行、可推动。一份好的临床试验方案或将为项目节约更多经济和时间成本,助推产品尽快上市。根据项目的需要和企业技术服务需求的不同,水木菁创配置与项目相匹配的技术团队,并且保证足够工时覆盖。医学中心撰写人员平均拥有两年及两年以上时长工作经验,40%以上人员具有五年以上撰写经验。医学中心看似复杂繁琐的流程,实则是为临床试验项目过程的缜密性负责。医疗器械的安全性直接关系到人体的生命安全,医学中心三大部门的循证医学,科学且严谨的方案设计,是临床试验项目可行性的坚强后盾。
一直以来,面对临床试验数据采集和传输追踪的耗时难题,使不少医疗器械企业颇为头疼。临床试验数据的采集是临床研究中的核心内容,真实、准确、及时、规范的数据采集能够显著提高临床试验的质量,缩短研究周期。水木菁创拥有先进的EDC系统,能更高效地完成临床试验电子数据采集及数据管理,数据管理过程与试验过程同步运行,相关岗位人员可实时管理、监查和追踪,完善工作流程管理。在传统模式中,临床试验主要依靠纸质的病例报告表(CRF)来完成数据的采集和管理过程。纸质数据只能通过人工手动处理,有疑虑的数据处理周期过长,无法高效利用。但在EDR系统支持下,系统能在第一时间发现各种缺失、超范围和无效数据,这样的好处是大幅缩减数据清理周期,提高工作效率。同时,EDC系统通过样本分配比例调整、对样本量重新估算,及时采集、掌握不良事件,尽早采取相应措施保护受试者权益等,这是纸质CRF做不到的地方。
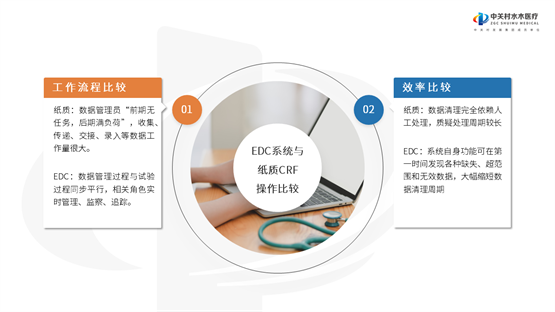
缩短研究周期,加快医疗器械转化速度,水木菁创实实在在地为企业省心省力省时。
法规事务中心:高品质服务,推进产品注册
医学中心为客户提供高效、严谨、可靠的临床试验方案、临床评价报告等,而法规事务中心则犹如珍珠项链中的丝线,贯穿项目始终,首先从企业是否满足生产、管理相关GMP体系进行介入,为产品安全性验证提供合规支持,其次在项目临床评价过程中,遵照相关医疗器械法规要求撰写、辅导、整理、搜集相关文献、文件。最后汇总所有注册文件向所属监管部门递交,并随时关注、跟踪项目发补、补正等情况,直至最终顺利取得医疗器械注册证。
高品质的服务,为推进产品快速注册赋能。水木菁创法规事务中心服务范围主要包括:国内外注册(有源/无源/IVD)、海外注册、GMP建立/辅导/审核等。团队参与过众多项目的执行与策划,对医疗器械市场行业有着丰富的积累和实践经验,人均注册经验十年以上,RAM经理注册经验平均十五年以上。团队参与的项目,累计取得医疗器械产品注册证书超过1080张。
法规事务中心创有12类核心SOP,通过合理的时间管理,团队在服务中多线并行优化项目时间,配合公司OA系统进行内部管理。在项目执行中,每一个项目,都会配置2-3位RA人员参与,并安排有同类产品操作经验者负责,多方资源整合、配合协作之下,能够稳定地为客户提供优质的服务。

疫情三年,水木菁创也走过艰辛的三年,如果没有过硬的技术、扎实的专业知识和丰富项目经验的团队,很难想象特殊时期这个新生命如何生存。水木菁创不但走过来了,而且团队不断壮大,业务不断充实。水木菁创一直深耕专业领域不断自我超越,也在新领域努力崛起,致力于将服务领域扩大到更大的范围,以服务更多的国内外医疗器械企业,造福病人。努力付出就会有回报,水木菁创用辛勤的汗水浇筑梦想的花儿,获得了中关村国家自主创新示范区高精尖产业创新平台、软件著作权登记证书、ISO 9001:2015质量管理体系认证等荣誉。未来,水木菁创将不断发展,竭力成为医疗器械CRO行业主力军。
如想了解更多相关内容,可以搜索并关注“水木菁创医药技术服务”微信公众号。